عنوان آزمایش: تهیه اتیلن
(برای تهیه ی اتیلن روش کارهای مختلفی را می توان در کتابهای شیمی و اینترنت پیدا کرد.اما با وجود یکسان بودن اصل روش،گاهاً دستور کار چندان ساده و ملموس نیست.در این مطلب سعی می کنم ساده ترین روش تهیه اتیلن را که در هر آزمایشگاه شیمی و با ساده ترین امکانات قابل انجام است،بنویسم.)
هدف: تهیه ی اتیلن به روش آزمایشگاهی از اتانول و شناسایی آن با محلول پتاسیم پرمنگنات
مقدمه:
اتیلن ساده ترین آلکن با فرمول C2H4 است.که گازی است بی رنگ و بسیار آتش گیر.
برای تهیه اتیلن روش های مختلفی وجود دارد که از جمله می توان کراکینگ گرمایی اتان(1) و آبگیری از الکل(اتانول) (2)را نام برد.که روش اول صنعتی و روش دوم بیشتر جنبه ی آزمایشگاهی دارد.
(1) CH3-CH3 => CH2=CH2 + H2
(2) CH3-CH2-OH => CH2=CH2 + H2O
اتیلن ( و سایر آلکن ها) با پتاسیم پرمنگنات اکسید می شوند و به این ترتیب رنگ ارغوانی آن را تغییر می دهند.همچنین با آب برم نیز واکنش داده و رنگ قرمز قهوه ای آن را از بین می برند.(روش های شناسایی آلکن ها)
(C2H4 + 2KMnO4+4H2O= 3 C2H4(OH)2 + 2KOH + 2MnO2(s
MnO2 منگنز دی اکسید (قهوه ای رنگ)
KMnO4 پتاسیم پرمنگنات (ارغوانی)
پس تغییر رنگ در طی شناسایی از ارغوانی به قهوه ای خواهد بود.
در صورت استفاده از آب برم تغییر رنگ از قهوه ای یا زرد آب برم به بی رنگ خواهد بود.
C2H4+Br2= C2H4Br2
Br2: برم( قهوه ای یا زرد رنگ)
C2H4Br2 : دی برمو اتیلن (بی رنگ)
در انتها می توان گاز خروجی از لوله ازمایش را با احتیاط آتش زد،که در این صورت گاز اتیلن شعله ور می شود.
از اتیلن در صنعت برای تهیه پلاستیک پلی اتیلن بسیار استفاده می شود.همچنین اتیلن نوعی هورمون گیاهی است که در کشاورزی برای رسیدن میوه هایی که بصورت نارس چیده می شوند(مثل موز) استفاده می شود.
روش کار:
یک تکه پنبه کوچک را به کمک همزن شیشه ای یا یک پیپت در ته یک لوله آزمایش بزرگ قرار می دهیم.چند سی سی اتانول را توسط پیپت روی پنبه ای که ته لوله آزمایش گذاشته ایم،میریزیم،به طوری که کاملاً آغشته به الکل شود.(این آغشته شدن به الکل باید در حدی باشد که موقع افقی کردن لوله آزمایش الکل از پنبه نریزد.) سپس لوله آزمایش را به صورت افقی به میله و پایه ی فلزی وصل می کنیم.به کمک اسپاتول مقداری پودر آلومینیوم اکسید(آلومین) را در وسط لوله آزمایش قرار می دهیم.در لوله آزمایش را با یک درپوش سوراخ دار بسته و لوله ی شیشه ای خمیده ای را به آن وصل می کنیم.(مطابق شکل).
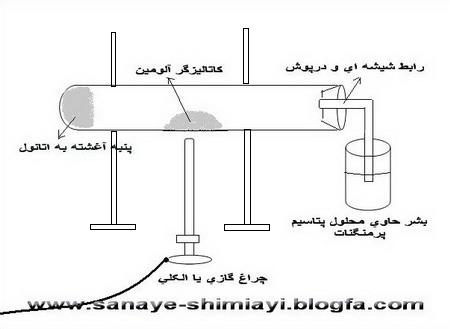
در یک بشر کوچک 50 سی سی تا نصف بشر محلول رقیق پتاسیم پرمنگنات( حدود 0.3% ) می ریزیم.و آن را زیر لوله رابط متصل به لوله آزمایش قرار می دهیم.حرارت را(در زیر قسمتی که آلومین قرار داده ایم) آغاز می کنیم.(گاهی نیز شعله را به سمت ته لوله آزمایش(جایی که پنبه را قرار داده ایم می بریم).اتانول در اثر حرارت و به کمک کاتالیزگر،آب زدایی شده و اتیلن تولید می کند.خروج گاز از لوله ی آزمایش با ایجاد حباب در محلول داخل بشر ثابت می شود.بخشی از این گاز بخار آب است و بخشی از آن گاز اتیلن.
با ورود اتیلن به داخل محلول پتاسیم پرمنگنات رنگ آن قهوه ای یا بی رنگ می شود.( بسته به اینکه محیط اسیدی باشد یا نه).
درست به همین روش می توان به جای پتاسیم پرمنگنات از آب برم نیز برای شناسایی اتیلن استفاده کرد.(بهتر است به جای برم از همن محلول پتاسی پرمنگنات برای ناسایی استفاده کرد چون برم سمی است و باعث سوختگی شدید پوست می شود)
در پایان گزارشکار باید نتیجه ی آزمایش و منابع احتمالی خطا را ذکر کرده و با توجه به مطالب گفته شده در مقدمه و متن روش کار،می توان به سوالات مربوطه پاسخ داد.
زندگینامه ی مندلیف

دیمتری ایوانویچ مندلیف شیمیدان بزرگ روسی در فوریه 1834 در شهر «توبوسك» در سیبری روسیه متولد شد او چهاردهمین فرزند خانواده بود پدرش مدیر مدرسه بود او پدر خود را در کودکی از دست داد. او در مدرسه توپولسک استعداد درخشان خود را در ریاضی و فیزیک نشان داد و عصرها بعد مدرسه در کارگاه شیشه گری به مادرش کمک می کرد مدتی بعد کارگاه شیشه گری آتش گرفت و همه سرمایه شان از دست رفت. دیمیتری برای یافتن شغل بهتر به سن پترزبورگ رفت و در آن جا به تدریس پرداخت در سال 1850 توانست بورس تحصیلی بگیرد و به تحصیل در رشته ریاضی، فیزیک و شیمی بپردازد. او خانواده خود را هم به سن پترزبورگ برد اما متاسفانه مادر و خواهرش به بیماری سل دچار شدند و جان خود را از دست دادند و او تنها شد فقر از یک سو و اندوه از سوی دیگر او را چنان بیمار ساخت که پزشکان تصور کردند او نیز به سل میتلا شده است و به او توصیه نمودند برای معالجه و استراحت به یک محل خوش آب و هوا مسافرت نماید. دیمیتری به جزایر کریمه رفت و مدتی را در آنجا ماند. پس از مدتی او سلامت روحی خود را بازیافت و به سنت پترزبورگ بازگشت...
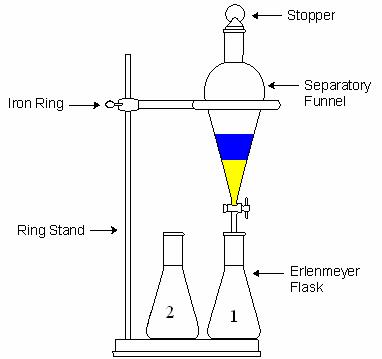
عنوان آزمایش: خالص سازی مواد به روش استخراج
هدف: استخراج آدیپیک اسید از فاز آبی به فاز آلی(اتر)
تئوری آزمایش:
استخراج روشی است برای جداسازی که در آن جسمی از یک فاز به فاز دیگر منتقل می شود. در بعضی مواقع لازم است برای بازیابی یک ماده آلی از راههایی غیر از تقطیر استفاده شود. یکی از این راهها تماس دادن محلول آبی با یک حلال غیر قابل اختلاط با آب است. اگر حلال مناسب باشد، بیشتر مواد آلی(در اینجا آدیپیک اسید) از لایه آبی به حلال آلی (که با آب امتزاج ناپذیر است) انتقال پیدا میکند.
از نظر کمی پخش یک جسم بین دو حلال غیر قابل امتزاج را بر حسب ضریب پخش K بیان میکنند. به عبارت دیگر ضریب پخش(k) یعنی: نسبت غلظت ماده ی حل شده در حلال اول، به غلظت همان ماده در حلال دوم.
حلالی که برای استخراج انتخاب می شود باید دارای این ویژگیها باشد:
1- با حلالی که دارای ماده مورد نظر است،مخلوط نشود.(سیستم دو فازی تشکیل دهد)
2- K ماده در حلال انتخاب شده بزرگ باشد. (یعنی ماده در حلال دوم بیشتر از حلال اول محلول باشد)
3- حلال نباید ما ماده مورد نظر واکنش دهد.
4- حلال انتخاب شده به آسانی تبخیر شود.
5- حلال نباید ناخالصی ها را استخراج کند.
در استخراج مایع-مایع از قیف جدا کننده (دکانتور) استفاده می شود.قیف نباید بیشتر از سه چهارم حجم آن پر شود چون در این صورت امکان هم زدن محلول وجود نخواهد داشت.هدف از تکان دادن و هم زدن این است که سطح تماس دو حلال افزایش یابد و ماده حل شده در حلال اول در مدت زمان کمتری بتواند به حلال دوم برود.(در آن حل شود).هر چند ثانیه یک بار باید قیف را برگرداند(شیر به سمت بالا) و آن را به آرامی باز کرد تا گاز قیف خارج شود.این عمل همیشه باید انجام شود ولی در دو حالت اهمیت بیشتری دارد:
1- وقتی که حلال مورد استفاده دمای جوش پایینی داشته باشد.
2- یک محلول اسیدی با محلولی از سدیم بیکربنات استخراج شود.(در این حالت گاز کربن دی اکسید آزاد می شود)
NaHCO3 + HA = NaA + H2O + CO2
پس از تکان دادن قیف و خارج کردن گازهای آن، قیف جدا کننده را روی گیره ی حلقه ای قرار می دهند و فرصت می دهند تا فازها به خوبی از هم جدا شوند.